A cura di Alice Galesi

Gli anestetici inalatori rappresentano una classe farmacologica caratterizzata da un rapido onset e offset, una bassa solubilità ematica e un’escrezione quasi esclusivamente polmonare. Tali proprietà farmacocinetiche li rendono ideali per il raggiungimento e il mantenimento di una sedazione controllabile e rapidamente reversibile, anche in pazienti con compromissione epatica o renale [1,2,3]. Dal punto di vista farmacodinamico, questi agenti inducono ipnosi, amnesia e, in parte, analgesia, con un meccanismo d’azione che coinvolge l’attivazione di recettori GABA-A e la modulazione di canali ionici neuronali [1,4].
Queste caratteristiche ne hanno storicamente favorito l’impiego in sala operatoria, dove isoflurano, sevoflurano e desflurano sono ampiamente utilizzati [1]. Fino a poco tempo fa, il loro utilizzo al di fuori dell’ambito anestesiologico risultava limitato, in quanto non erano disponibili dispositivi compatibili con i ventilatori da terapia intensiva per una somministrazione prolungata.
Negli ultimi anni, l’introduzione di sistemi specificamente progettati per l’ambiente intensivo ha reso possibile la somministrazione di anestetici inalatori quali sevoflurano e isoflurano anche nei pazienti sottoposti a ventilazione meccanica prolungata. L’impiego di desflurano, al contrario, non è erogabile con tutti i devices disponibili in commercio, a causa del suo basso punto di ebollizione, che lo rende instabile a temperatura ambiente [2,5].
Questa evoluzione tecnologica ha aperto nuove prospettive per l’utilizzo di sedazione inalatoria in terapia intensiva, offrendo un’alternativa ai sedativi endovenosi tradizionali, che pur essendo efficaci, presentano limiti legati all’accumulo, alla variabilità interindividuale e al rischio di tolleranza [1,3].
Nonostante i potenziali vantaggi, l’adozione routinaria degli anestetici volatili in terapia intensiva è ancora condizionata da variabili cliniche e logistiche, quali la disponibilità degli strumenti idonei per l’erogazione, la formazione del personale e la qualità delle evidenze scientifiche disponibili [6,7].
In terapia intensiva, gli anestetici volatili vengono somministrati tramite dispositivi di conservazione dell’anestesia (ACD), come AnaConDa™ e Mirus™ [8]. Questi sistemi sono composti da uno scambiatore di umidità e calore (HME) accoppiato ad un elemento riflettente (chiamato riflettore) che consente di assorbire l’anestetico espirato restituendolo al paziente durante l’inspirazione successiva, riducendo in questo modo il consumo di farmaco [8,5].
In questo articolo si approfondirà il sistema AnaConDa™ o come chiamato più recentemente Sedaconda ACD.
Come mostrato nella figura 1, l’ACD è posizionato tra il raccordo a Y del circuito ventilatorio e il tubo endotracheale (1). Include una linea per l’infusione continua dell’agente anestetico (2) tramite pompa siringa (3), una linea di campionamento per il monitoraggio continuo della concentrazione dell’anestetico nel volume d’aria espirato (4) e un sistema di evacuazione dei gas (5) [9,5]. È importante che il dispositivo sia orientato con una lieve inclinazione verso il basso per evitare accumulo di liquidi.
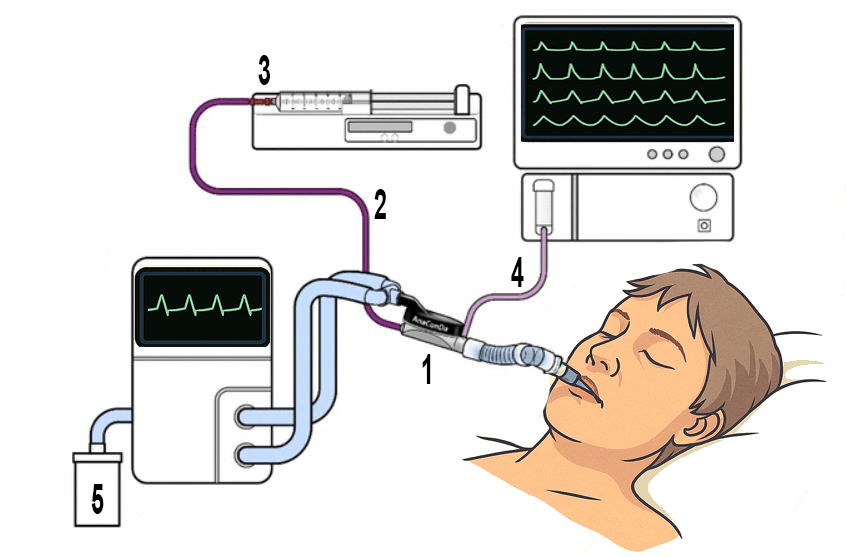
Il monitoraggio della concentrazione espirata dell’agente anestetico è essenziale per una sedazione precisa e sicura [9,5]. A tale scopo, un parametro di riferimento comunemente utilizzato è la MAC (Minimum Alveolar Concentration), che rappresenta la concentrazione alveolare di un anestetico volatile necessaria per prevenire il movimento in risposta a uno stimolo doloroso nel 50% dei pazienti. Sebbene sviluppata come misura della profondità anestesiologica in sala operatoria, la MAC è impiegata anche in terapia intensiva per titolare la sedazione, a valori inferiori rispetto all’anestesia generale. Durante la sedazione in ventilazione meccanica, i valori di MAC comunemente utilizzati si collocano tra 0,25 e 0,6. Tali concentrazioni consentono di ottenere una sedazione efficace, con un buon profilo emodinamico, risvegli rapidi e minori effetti collaterali dose-dipendenti [10].
Caratteristiche e gestione del dispositivo
L’efficienza del riflettore nel recuperare fino al 90% dell’agente anestetico espirato consente un notevole risparmio sul consumo del farmaco. Il filtro ACD deve essere sostituito ogni 24 ore per garantirne la funzionalità ed evitare accumuli di umidità [8]. Le siringhe contenenti l’anestetico possono essere pre-riempite e utilizzate entro cinque giorni se conservate correttamente [9].
Nel caso di aspirazione tracheale, se non si utilizza un sistema di aspirazione chiuso, è necessario fermare la pompa e scollegare il dispositivo prima dal raccordo a Y e poi dal tubo endotracheale, per evitare contaminazioni o errori nel sistema [11].
La velocità di infusione deve essere regolata sulla base della valutazione clinica, emodinamica e della concentrazione espiratoria del gas. Per esempio, per l’isoflurano la dose iniziale è di 3 ml/h, con un intervallo di regolazione tra 2 e 8 ml/h, mentre per il sevoflurano la dose iniziale è di 5 ml/h, con un intervallo che può variare tra 3 e 20 ml/h [9].
In situazioni speciali, come nel caso dell’utilizzo di ossido nitrico, dove l’umidificazione attiva è necessaria, si utilizza una configurazione diversa del dispositivo ACD, posizionandolo sulla branca inspiratoria prima dell’umidificatore (via inspiratoria lato secco del respiratore) [11].
Un problema potenziale è rappresentato dallo spontaneous drug delivery, in cui bolle di gas presenti nella siringa o variazioni di pressione possono causare un’infusione non controllata del liquido anestetico. Per prevenire tale rischio, è fondamentale evitare boli manuali per il riempimento della linea di infusione che conduce l’anestetico all’ACD, evitare fonti di calore in prossimità della siringa (quali monitor, radiatori o altre apparecchiature che potrebbero aumentare la temperatura del liquido), utilizzare il raccordo dedicato per l’aspirazione dell’anestetico dal flacone rimuovendo accuratamente eventuali bolle d’aria e mantenere la pompa siringa all’altezza o al di sotto della testa del paziente [9,5].
Secondo il manuale d’uso, con AnaConDa™ è possibile utilizzare un nebulizzatore mesh senza influire sulle concentrazioni degli anestetici volatili. Il nebulizzatore deve essere posizionato tra il tubo endotracheale e l’ACD, mentre l’analizzatore di gas deve essere messo in modalità standby durante la nebulizzazione per evitare che il farmaco entri nel tubo di campionamento. Tuttavia, nebulizzazioni ripetute possono aumentare la resistenza al flusso dell’ACD, per cui è necessario monitorare il sistema respiratorio per segni d’ostruzione [11].
La concentrazione dell’anestetico può variare in base al volume respiratorio minuto. Un aumento dell’attività respiratoria spontanea, ad esempio, porta a una riduzione della concentrazione, che potrebbe influire sul livello di sedazione del paziente [5].
Infine, è necessario adottare un sistema di evacuazione dei gas esalati, tramite filtro a carbone attivo o connessione all’impianto di aspirazione centralizzato, per evitare la contaminazione ambientale [4,5].
Effetti collaterali e profilo di sicurezza
Rispetto ai sedativi endovenosi, gli anestetici inalatori non mostrano accumulo sistemico, garantendo un profilo farmacocinetico più prevedibile e risvegli più rapidi anche dopo sedazioni prolungate [3,12]. Tuttavia, il sevoflurano, se utilizzato a dosi elevate e per lunghi periodi, può causare un incremento dei livelli di fluoruri inorganici, provocando poliuria e, in alcuni casi, un diabete insipido nefrogenico reversibile [7,12].
Tra gli effetti avversi noti figurano ipotensione dose-dipendente, aumento della pressione intracranica e rischio di ipertermia maligna, sebbene quest’ultima sia rara [7,4,12]. Il profilo emodinamico degli agenti volatili è paragonabile a quello dei sedativi EV e può essere gestito efficacemente tramite monitoraggio continuo e aggiustamento della dose [7].
Indicazioni all’uso degli anestetici volatili in terapia intensiva
Le principali indicazioni all’utilizzo degli anestetici volatili in terapia intensiva includono:
- Sedazione prolungata in ventilazione meccanica: gli anestetici volatili rappresentano un’opzione efficace per la sedazione di pazienti sottoposti a ventilazione meccanica prolungata, grazie alla rapidità di risveglio e alla possibilità di titolazione precisa. Diversi studi hanno dimostrato che questi farmaci consentono una più agevole interruzione della sedazione e una riduzione dei tempi di estubazione rispetto ai sedativi EV [7,3,13].
- Sedazione postoperatoria: in particolare dopo chirurgia cardiaca o maggiore non cardiaca, l’uso di anestetici inalatori in terapia intensiva si associa a un risveglio più rapido e a una possibile protezione miocardica rispetto alla sedazione con propofol [7,13]. Alcune evidenze suggeriscono inoltre un effetto antinfiammatorio e di riduzione dello stress ossidativo [13].
- Stato asmatico: l’isoflurano ha mostrato proprietà broncodilatatorie utili nei pazienti con broncospasmo severo e stato asmatico refrattario. In tali contesti, è stato associato a miglioramenti dei gas ematici e a una riduzione della pCO₂ [7,14].
- Stato epilettico refrattario: gli anestetici volatili possono essere impiegati nei casi di stato epilettico refrattario, grazie alla loro capacità di sopprimere l’attività elettrica cerebrale e di ridurre il metabolismo cerebrale, pur mantenendo la reattività vascolare alla CO₂ [7,14].
- Sedazione difficoltosa o tolleranza ai sedativi EV: i pazienti con tolleranza o risposta inadeguata ai sedativi endovenosi possono beneficiare di una sedazione inalatoria, che offre un meccanismo d’azione differente e meno suscettibile a tachifilassi [7,3,14].
- ARDS: l’utilizzo di anestetici inalatori nei pazienti con sindrome da distress respiratorio acuto è stato associato in alcuni studi a un miglioramento dell’ossigenazione e a una riduzione dell’edema alveolare [14,15].
Controindicazioni
Sebbene l’uso degli anestetici volatili in terapia intensiva sia generalmente sicuro, esistono alcune controindicazioni da considerare:
- Ipertermia maligna: rappresenta una controindicazione assoluta. L’uso di agenti alogenati deve essere evitato nei pazienti con una storia personale o familiare di ipertermia maligna [4,16].
- Reazioni idiosincratiche agli alogenati: in caso di precedenti episodi di epatotossicità da anestetici volatili, l’impiego dovrebbe essere evitato per rischio di recidiva [16].
- Aumento della pressione intracranica: sebbene l’evidenza sia controversa, è consigliabile usare cautela nei pazienti con ipertensione endocranica non controllata, a causa della possibile vasodilatazione cerebrale indotta dagli agenti volatili [7,16].
- Instabilità emodinamica: l’effetto vasodilatatore sistemico può accentuare stati di ipotensione. L’uso richiede monitoraggio attento e un bilancio accurato tra beneficio sedativo e rischio emodinamico [7].
- Gravidanza: i dati sull’uso in gravidanza sono limitati e, in assenza di indicazioni specifiche, l’impiego è da valutare caso per caso [16].
- Bassi volumi correnti: lo spazio morto del riflettore rappresenta un limite importante. L’utilizzo del sistema AnaConDa™ è controindicato quando il volume corrente impostato sul ventilatore è inferiore a 350 ml con il riflettore da 100 ml, o inferiore a 200 ml con il riflettore da 50 ml [5].
Conclusioni
L’impiego degli anestetici inalatori in terapia intensiva rappresenta una strategia sedativa sempre più esplorata, sostenuta da solidi presupposti farmacologici e da un crescente corpo di evidenze cliniche. Le caratteristiche farmacocinetiche favorevoli, l’assenza di accumulo e la possibilità di un rapido recupero funzionale rendono questi agenti particolarmente adatti alla sedazione prolungata dei pazienti ventilati. L’introduzione di dispositivi dedicati come AnaConDa™ ha reso concretamente attuabile la loro somministrazione anche al di fuori della sala operatoria.
Tuttavia, il loro utilizzo sistematico in terapia intensiva richiede un’attenta valutazione del rapporto rischio-beneficio, tenendo conto delle indicazioni cliniche specifiche, delle controindicazioni note e delle limitazioni tecniche legate alla gestione del dispositivo. La disponibilità di dispositivi a basso spazio morto, l’adozione di protocolli condivisi e un’adeguata formazione del personale sono condizioni essenziali per un impiego sicuro ed efficace.
In un contesto clinico in continua evoluzione, l’integrazione degli anestetici inalatori nei protocolli di sedazione intensiva potrebbe rappresentare un importante passo avanti. Ulteriori studi randomizzati controllati saranno fondamentali per definire con maggiore precisione i benefici e i limiti di questa tecnica.
BIBLIOGRAFIA
- Brian O’Gara, Christina Boncyk, Andreas Meiser, Angela Jerath, Martin Bellgardt, Matthieu Jabaudon, Jeremy R. Beitler, Christopher G. Hughes; Volatile Anesthetic Sedation for Critically Ill Patients. Anesthesiology 2024; 141:163–174. https://doi.org/10.1097/ALN.0000000000004994
- Jabaudon M, Zhai R, Blondonnet R, Bonda WLM. Inhaled sedation in the intensive care unit. Anaesth Crit Care Pain Med. 2022 Oct;41(5):101133. https://doi.org/10.1016/j.accpm.2022.101133
- Al Aseri Z, Alansari MA, Al-Shami SA, Alaskar B, Aljumaiah D, Elhazmi A. The advantages of inhalational sedation using an anesthetic-conserving device versus intravenous sedatives in an intensive care unit setting: A systematic review. Ann Thorac Med. 2023;18(4):182-189. https://doi.org/10.4103/atm.atm_89_23
- Wieruszewski ED, ElSaban M, Wieruszewski PM, Smischney NJ. Inhaled volatile anesthetics in the intensive care unit. World J Crit Care Med. 2024;13(1):90746. https://doi.org/10.5492/wjccm.v13.i1.90746
- Bomberg H, Volk T, Groesdonk HV, Meiser A. Efficient application of volatile anaesthetics: total rebreathing or specific reflection? J Clin Monit Comput. 2018;32(4):615-622. https://doi.org/10.1007/s10877-017-0096-x
- Meiser A, et al. Inhaled isoflurane via the anaesthetic conserving device versus propofol for sedation… Lancet Respir Med. 2021;9(11):1231-1240. https://doi.org/10.1016/S2213-2600(21)00323-4
- Shankar V, et al. Isoflurane therapy for severe refractory status asthmaticus in children. Intensive Care Med. 2006;32(6):927-33. https://doi.org/10.1007/s00134-006-0163-0
- Farrell R, Oomen G, Carey P. A technical review of the AnaConDa. J Clin Monit Comput. 2018;32:595–604. https://doi.org/10.1007/s10877-017-0097-9
- Guerrero Orriach JL, et al. Decreased nitric oxide concentration with the AnaConDa device. Anesth Analg. 2011;113(3):664-5. https://doi.org/10.1213/ANE.0b013e318223c5f5
- Blanchard F, et al. Minimal alveolar concentration for deep sedation (MAC-DS) in intensive care unit patients sedated with sevoflurane: A physiological study. Anaesth Crit Care Pain Med. 2020 Jun;39(3):429-434. doi:10.1016/j.accpm.2020.04.002.
- Sedana Medical. Sedaconda ACD – User Guide. Versione 2021. Disponibile su: https://sedanamedical.com/media/ovmaxjuw/sed0012_userguide_a5_en_2108-booklet.pdf
- L’Heudé M, et al. Nephrotoxicity of sevoflurane: myth or reality? Ann Fr Anesth Reanim. 2019.
- Jerath A, et al. Volatile-based sedation in critical care: current and emerging evidence. Best Pract Res Clin Anaesthesiol. 2016;30(4):465–476.
- Jabaudon M, et al. Sevoflurane for Sedation in Acute Respiratory Distress Syndrome. A Randomized Controlled Pilot Study. Am J Respir Crit Care Med. 2017 Mar 15;195(6):792-800. doi: 10.1164/rccm.201604-0686OC.
- Koutsogiannaki S, et al. The Use of Volatile Anesthetics as Sedatives for Acute Respiratory Distress Syndrome. Transl Perioper Pain Med. 2019;6(2):27-38. doi: 10.31480/2330-4871/084.
- Gorsky ME, et al. Volatile anesthetics in ICU: applications and precautions. Crit Care Clin. 2024;40(2):201–219.
L’autore dichiara l’assenza di conflitti di interesse in relazione al contenuto del presente articolo e ai dispositivi citati.