Matteo Manici – Infermiere di Terapia Intensiva, AOU Parma – IT
Stefano Parise – Infermiere Specialista Clinico di Cure Intense, Ospedale Regionale di Lugano, EOC – CH
Stefano Bambi – Professore Associato Med.45 – Università degli Studi di Firenze-IT
Alberto Lucchini – Coordinatore Infermieristico Terapia Intensiva Generale, San Gerardo ASST Monza Brianza – IT

In condizioni fisiologiche le secrezioni delle mucose respiratorie (naso, cavo orale, trachea, bronchi) sono trasparenti e fluido-viscose; vengono “spazzolate” verso l’alto dalle ciglia vibratili ed espettorate all’esterno, oppure deglutite nel tratto digerente. In condizioni patologiche, le secrezioni possono assumere aspetto e caratteristiche diverse: sierose, mucose, catarrali, mucopurulente, purulente, emorragiche, ematico-gelatinose, rugginose, schiumose, fetide o fibrinose. Sfugge agli obiettivi di questo post identificare le cause eziopatogenetiche alla base della modificazione patologica delle secrezioni respiratorie, ma molte di loro sono legate a condizioni che si verificano nell’assistito e che portano al posizionamento di una via aerea artificiale (tubo endotracheale, cannula tracheostomica, tracheostomia definitiva).
Alterazioni della viscosità del muco su base patologica e la stessa via aerea artificiale, poi, spesso causano alterazione della consistenza e dell’idratazione del muco e della sua viscosità. Con la sola esclusione della tracheostomia definitiva – la tecnica chirurgica di abboccamento della trachea al giugulo normalmente effettuata a seguito di laringectomia – che prevede l’integrità della mucosa respiratoria fino al passaggio tracheo-cutaneo, tutte le altre vie aeree artificiali prevedono che la via aerea naturale venga bypassata da un tubo di lunghezza variabile (nell’adulto da 6-8 cm per le cannule a 30-35 cm per i tubi) che, di fatto, interrompe la progressione caudo-craniale delle secrezioni respiratorie provocandone un accumulo a livello della carena tracheale, il punto in cui la trachea si divide nei due bronchi principali destro e sinistro. Se questo problema potesse essere affrontato con una innovazione tecnologica, l’inventore di tubi “cigliati” vincerebbe certamente il premio Nobel per la medicina! Inoltre, per ovvi motivi, la persona con via aerea artificiale, se in ventilazione meccanica, non può espellere spontaneamente le secrezioni, nemmeno con meccanismi di clearence delle vie aeree efficaci, proprio per la presenza del circuito respiratorio, che per definizione è privo di comunicazione con l’esterno.
L’assistenza alla persona con via aerea artificiale necessita, quindi, di una tecnica efficace e sicura di rimozione delle secrezioni respiratorie attuata principalmente mediante l’aspirazione. Questa tecnica è spesso chiamata impropriamente “broncoaspirazione”, anche se il termine non ha alcun significato clinico. Il livello bronchiale dell’albero respiratorio è generalmente troppo profondo per una comune aspirazione (a quel livello non arriva il tubo e, quindi, le ciglia funzionano normalmente con un adeguato condizionamento dei gas inspirati) e, oltre a questo, il bronco sinistro è anatomicamente troppo angolato e la sua aspirazione è possibile solo in specifici contesti con tubi bronchiali o sondini di aspirazione “selettivi” o “angolati”. Diventa, quindi, necessario utilizzare il nome aspirazione della via aerea artificiale per questa tecnica, in analogia alla terminologia inglese artificial airway suctioning che si ritrova in letteratura.
L’aspirazione della via aerea artificiale è una pratica di assistenza al malato critico utilizzata fin dall’introduzione della prima protesi respiratoria endotracheale. Il “come” farlo si è modificato negli anni, partendo da usi e costumi locali degli operatori sanitari trasmessi ai colleghi nei percorsi di inserimento lavorativo, evolvendo sui risultati delle prove di efficacia, le evidence based practice, fino ad arrivare ad essere codificato un po’ per tutti in una nota Clinical Practice Guidelines (CPG) del 2010 diffuso da AARC, American Association for Respiratory Care1, che forniva indicazioni sull’aspirazione delle vie aeree artificiali durante ventilazione meccanica. Oggi, a distanza di 12 anni, l’AARC fa un passo avanti e propone un unico documento per tutti i setting assistenziali, intitolato “AARC Clinical Practice Guidelines: Artificial Airway Suctioning”2. Per una lettura attenta ed approfondita del documento, si rimanda direttamente al link https://rc.rcjournal.com/content/67/2/258#:~:text=The%202010%20AARC%20CPG1,the%20appropriateness%20score%20at%207)
Questo articolo ha l’obiettivo di contribuire all’interpretazione dei principali cambiamenti e dei trend evolutivi contenuti nella CPG 2022 rispetto a quelli del 2010, nel quadro generale di un documento che, pur offrendo una serie di raccomandazioni in buona parte sovrapponibili al precedente, è stato costruito mediante una struttura basata su 11 quesiti di ricerca (PICO), identificati dal panel di esperti che ha redatto il lavoro seguendo l’evoluzione delle prove scientifiche che guidano le attuali pratiche cliniche.
I quesiti clinici posti dagli esperti, sono:
- Quali sono le indicazioni e le complicanze dell’aspirazione delle vie aeree artificiali nella popolazione neonatale, pediatrica e adulta?
- L’aspirazione delle vie aeree artificiali dovrebbe essere eseguita routinariamente o solo in base alle necessità?
- L’aspirazione delle vie aeree artificiali deve essere eseguita utilizzando sistemi aperti o chiusi?
- I pazienti devono essere preossigenati e/o iperossigenati prima dell’aspirazione?
- La soluzione fisiologica deve essere utilizzata durante l’aspirazione delle vie aeree artificiali?
- L’aspirazione aperta di una via aerea artificiale dovrebbe essere eseguita come una procedura pulita o come una procedura sterile?
- Quale dimensione del catetere di aspirazione e quale pressione di aspirazione dovrebbero essere impiegati per aspirare le vie aeree artificiali?
- Quale limite di tempo dovrebbe essere imposto alla durata della manovra di aspirazione?
- Una tecnica di aspirazione superficiale è preferita a una tecnica di aspirazione profonda?
- Quando dovrebbe essere utilizzata la broncoscopia al posto delle tecniche di aspirazione aperte o chiuse?
- Quando dovrebbero essere utilizzati i dispositivi di disostruzione delle vie aeree artificiali (brushing) in aggiunta alla aspirazione?
La tabella 1 sintetizza, mediante una sinossi con commenti, le principali differenze tra le CPG del 2010 e del 2022.

Qui di seguito, si riportano alcune riflessioni e commenti alla tabella 1:
PRESENZA DI SECREZIONI
L’aspirazione della via aerea non è un metodo per evidenziare l’accumulo di secrezioni tracheo-bronchiali, ma la terapia dell’occlusione della via aerea artificiale. L’aspirazione è una terapia, non una diagnosi. Nell’era dell’infermieristica basata sulle evidenze, l’infermiere deve abbandonare definitivamente la logica dell’assistenza condotta per tentativi ed errore a favore di approcci basati sulle prove di efficacia e sulla valutazione puntuale degli esiti. Ogni “tentativo” di rimuovere secrezioni in modo routinario o per escluderne la presenza deve essere evitato. L’aspirazione della via aerea artificiale è, in ogni caso, una manovra dolorosa, definita come tra le più dolorose in terapia intensiva3, non priva di effetti collaterali come alterazioni respiratorie, cardiache, sanguinamento ed infezioni4.
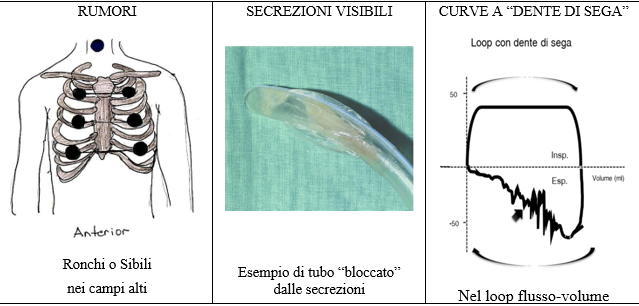
L’aspirazione delle secrezioni deve avvenire se sono presenti rumori respiratori (ronchi o sibili nei campi alti, principalmente espiratori), secrezioni visibili nel tubo tracheale o tracheostomico o nel catetere-mount o presenza di alterazioni delle curve di ventilazione con la tipica evidenza dell’aspetto a “dente di sega” nel loop flusso-volume o nella fase espiratoria del diagramma flusso-tempo.
PRE-OSSIGENAZIONE
L’evidenza supporta la pre-ossigenazione, ma il 100% di ossigeno non è richiesto per tutti gli assistiti. AARC nel 2010 raccomandava di utilizzare ossigeno al 100% per assistiti adulti e pediatrici prima di aspirare regolando manualmente l’ossigeno, o utilizzando il programma di pre-ossigenazione temporanea sul ventilatore. La ventilazione manuale (con pallone va e vieni o simile) non era raccomandata. Attualmente sono disponibili evidenze che queste raccomandazioni sono appropriate, anche se la pre-ossigenazione con una FIO2 aumentata del 20% sopra al valore basale (anziché del 100%), sembra che sia sufficiente negli assisiti adulti e pediatrici2. Non sono disponibili evidenze per i neonati.
PROFONDITÀ
L’aspirazione superficiale è definita come l’inserimento di un catetere di aspirazione a una profondità predeterminata, solitamente la lunghezza del tubo (endotracheale o tracheostomico) più l’adattatore (catetere-mount). L’aspirazione profonda è definita come l’inserimento di un catetere di aspirazione fino a quando non si incontra resistenza, seguito dal ritiro del catetere di 1 cm prima dell’applicazione della pressione negativa.
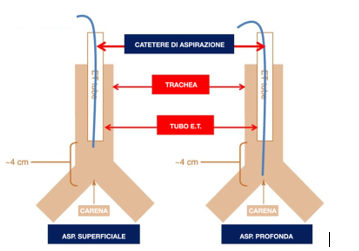
L’aspirazione superficiale e profonda alterano gli indici fisiologici in modo simile (frequenza respiratoria e SatO2). L’aspirazione profonda può essere effettuata meno frequentemente (perché pulisce il campo in modo più completo), però può essere associata a traumi delle vie aeree. L’indicazione alla aspirazione superficiale di AARC 2010 non è stata confermata da evidenze convincenti. Se l’aspirazione superficiale è da utilizzarsi come routine per evitare potenziali traumi delle vie aeree, l’aspirazione profonda può essere utilizzata solamente se la prima non è efficace. La broncoscopia di routine o di “toilette” per la rimozione delle secrezioni non è raccomandata2.
DIAMETRO SONDINO E PRESSIONE DI ASPIRAZIONE
Sulla base delle evidenze disponibili, sembra che le diverse dimensioni del catetere di aspirazione e delle pressioni di aspirazione possano causare alterazioni fisiologiche (saturazione, frequenza respiratoria, frequenza cardiaca, pressione arteriosa sistolica, dolore, quantità delle secrezioni). Al momento, tuttavia, non è chiaro il rapporto ottimale tra le dimensioni del diametro esterno del catetere di aspirazione e il diametro interno delle vie aeree artificiali. Non è chiara nemmeno la pressione di aspirazione ottimale applicata in termini di sicurezza ed efficacia.

Le CPG AARC 2010 raccomandavano che i cateteri di aspirazione dovessero occludere meno del 50% del lume del tubo negli assistiti pediatrici e adulti e meno del 70% nei neonati. Nessuna nuova evidenza confuta in modo convincente questa raccomandazione. Vi sono modeste evidenze che le pressioni di aspirazione dovrebbero essere mantenute al di sotto di –200 mmHg negli adulti e -120 mm Hg nei neonati e pediatrici.
In ogni caso dovrebbero essere compiuti sforzi per impostare la pressione di aspirazione il più bassa possibile per eliminare efficacemente le secrezioni.
| mmHg | mBar/hPascal | |
| Neonati e pediatrici | -120 | -160 |
| Adulti | -200 | -267 |
DURATA
Limitare il tempo di aspirazione è una strategia intuitiva per mitigare le potenziali complicanze o i rischi derivanti dall’aspirazione dei secreti. Il tempo massimo di 15 secondi è più aneddotico che sostenuto da solide evidenze. L’aspirazione deve comunque essere il più breve possibile e, se possibile, non durare più a lungo di 15”.
INSTILLAZIONE DI SOLUZIONE SALINA
Le AARC 2010 suggeriscono di non eseguire l’uso di routine della instillazione di soluzione fisiologica prima dell’aspirazione endotracheale. Nessuna nuova evidenza ha modificato questa raccomandazione. L’instillazione di soluzione fisiologica, qualora necessaria per sbloccare una via aerea artificiale da secrezioni troppo dense, deve essere eseguita con parsimonia e tenendo in considerazione il potenziale di eventi avversi, come una diminuzione della saturazione di ossigeno, tosse eccessiva, broncospasmo, tachicardia, dispnea, un aumento della pressione intracranica e la rimozione di biofilm batterico (spingendolo a valle delle vie aeree artificiali).
SISTEMI DI ASPIRAZIONE
I sistemi di aspirazione aperti o chiusi possono essere utilizzati in modo sicuro ed efficace per rimuovere le secrezioni dell’assistito adulto con via aerea artificiale. L’aspirazione è eseguita tradizionalmente con la disconnessione dal ventilatore e l’introduzione del catetere di aspirazione nel tubo endotracheale. In alternativa, può essere realizzato con un sistema di aspirazione chiuso incluso nel circuito ventilatorio, che consente di introdurre il catetere nelle vie aeree senza scollegare il paziente dal ventilatore5. Questo sistema si è reso disponibile sul mercato dalla fine degli anni ’90 con l’avvento di ventilatori polmonari capaci di tollerare la depressione di aspirazione senza compromettere la funzionalità delle proprie testate. Sebbene le differenze dimostrate degli studi tra il sistema di aspirazione chiuso e il sistema di aspirazione aperto siano minime, nella popolazione neonatale e pediatrica l’utilizzo di un sistema di aspirazione chiuso è riportato dagli estensori di CPG 2022 come “logico”. In ogni caso, l’operatore sanitario deve utilizzare adeguate misure di controllo delle infezioni e precauzioni di sicurezza per evitare eventi avversi, come cambiamenti dei parametri fisiologici e danni alla mucosa delle vie aeree in base al sistema di aspirazione utilizzato.
Quando è presente un catetere-mount dotato di tappo in gomma perforato, per aspirazione “aperta” si intende quella effettuata aprendo la porta “grande” del sistema, oppure deconnettendo il mount dal raccordo a 15 mm del tubo tracheale o tubo tracheostomico. La porta “piccola”, infatti, nasce per l’esecuzione della broncoscopia. Questo va considerato nell’interpretazione della lettura delle linee guida americane, perché l’utilizzo del catetere mount non è comune oltreoceano, anche se non sono reperibili dati certi circa il suo utilizzo.
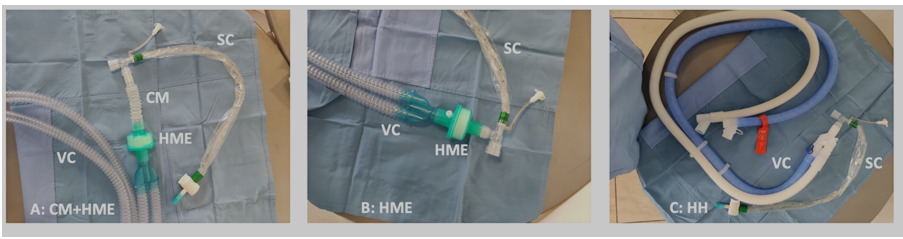
(C): SC e VC collegati con umidificatore riscaldato (HH). Modificato da Shimoda T et al.6
Accanto a sistema “aperto” e a quello “chiuso” (in-line), dobbiamo nei fatti accostare un sistema semi-chiuso, che prevede la manovra di aspirazione della via aerea eseguita infilando il sondino attraverso la porta “piccola” del catete mount, con un diametro di circa 3-5 mm. L’accesso nasce, in origine, per eseguire la broncoscopia. Questo approccio non è previsto dalla CPG 2010 e 2022, ma l’esperienza clinica suggerisce di introdurlo alla discussione, anche in considerazione della diffusione di presidi con doppio accesso messo a disposizione dell’industria medicale. Il sistema permette di ridurre il de-reclutamento grazie all’intervento del ventilatore a compensazione delle perdite che, nei ventilatori odierni, è decisamente efficace (durante la ventilazione a volume controllato, ad esempio, il ventilatore può erogare un volume aggiuntivo in modo da compensare le perdite fino al 100% del volume corrente impostato). La difficoltà di inserimento della sonda di aspirazione in un pertugio molto stretto, però, genera anche maggiori problematiche di mantenimento della sterilità della punta del catetere e, poi, stimola delle riflessioni circa la possibilità (o la necessità) di eseguire manovre di disinfezione del sistema di accesso alla via aerea, al pari di quello che avviene con la disinfezione dei needle-free connector per l’accesso al sistema vascolare. Sarebbero necessari ulteriori studi per determinare la capacità di tenuta della PEEP in fase di apertura della porta accessoria e della capacità di garantire la sterilità della punta del catetere con l’utilizzo di questo accesso.

A sinistra foro grande di aspirazione, a destra foro piccolo per broncoscopia. Foto da internet.
STERILITÀ & co.
Quando si esegue una procedura di aspirazione delle vie aeree artificiali aperta, è necessario garantire misure che proteggano sia l’assistito che il clinico dagli agenti patogeni.
Per quanto riguarda la protezione del personale, è mandatorio l’utilizzo di presidi barriera (guanti, camici, copricapo, occhiali) che impediscano il contatto di sostanze biologiche dell’assistito con l’operatore (in particolare con mucose e sclere) e riducano l’inquinamento della divisa di servizio per il rischio che rappresenta nella trasmissione crociata di infezioni tra diversi assistiti.
Per quanto riguarda l’assistito, è stata spesso discussa la necessità di applicare una tecnica “sterile” rispetto a una “pulita” per la broncoaspirazione aperta. Alcuni sostengono che la sterilità dell’operatore è irrilevante perché il catetere di aspirazione aperto passerà attraverso un campo non sterile (mount e via aerea artificiale) e, quindi, i successivi passaggi del catetere non saranno sterili. Dall’altro canto le linee guida CDC 20037 per la prevenzione delle polmoniti nosocomiali ha riconosciuto che l’aspirazione tracheale aumenta le opportunità di contaminazione crociata e che il rischio può essere ridotto utilizzando una tecnica asettica (sterile).
C’è una lacuna nella letteratura per quanto riguarda le differenze di esito clinicamente rilevanti tra tecnica pulita e sterile per l’aspirazione artificiale delle vie aeree. Non crediamo sia possibile che questo gap conoscitivo possa essere colmato in futuro: è eticamente inaccettabile raccomandare che vengano condotte ulteriori ricerche per affrontare questa lacuna, considerato il potenziale danno che un ambiente “meno che sterile” potrebbe provocare all’assistito.
Il board di AARC, per questo motivo, suggerisce, sull’esperienza dei propri membri, di utilizzare la tecnica sterile, ove possibile, per l’aspirazione dell’assistito in circuito aperto. Il lavaggio delle mani per le tecniche sterili, come noto, non è il lavaggio sociale o il semplice l’utilizzo di gel idroalcolico che si attua immediatamente prima e subito dopo il contatto con il letto o la stanza dell’assistito, ma un lavaggio con sapone antisettico che dovrebbe durare dai 40 ai 60 secondi.
DISPOSITIVI DI BRUSHING DELLE VIE AEREE ARTIFICIALI (TUBO)
Sono stati sviluppati vari dispositivi allo scopo di ripulire i tubi da secrezioni e biofilm che potrebbero aumentare la resistenza delle vie aeree e provocare l’ostruzione completa delle vie aeree. Questi dispositivi sono utilizzati in aggiunta ai cateteri di aspirazione standard per mantenere il diametro interno dei tubi, anche se gli studi a sostegno non dimostrano miglioramento di outcome quali giorni di VM, giorni di terapia intensiva o giorni di intubazione. Non è noto se questi dispositivi debbano essere utilizzati in modo intermittente o come parte della gestione ordinaria delle vie aeree.

per la rimozione critica delle occlusioni e tappo rimosso. Da Stone R et Bricknell S.8
BIBLIOGRAFIA
1. American Association for Respiratory Care. AARC Clinical Practice Guidelines. Endotracheal suctioning of mechanically ventilated patients with artificial airways 2010. Respir Care. 2010 Jun;55(6):758–64.
2. Blakeman TC, Scott JB, Yoder MA, Capellari E, Strickland SL. AARC Clinical Practice Guidelines: Artificial Airway Suctioning. Respir Care. 2022 Feb 24;67(2):258–71.
3. Devlin JW, Skrobik Y, Gélinas C, Needham DM, Slooter AJC, Pandharipande PP, et al. Clinical Practice Guidelines for the Prevention and Management of Pain, Agitation/Sedation, Delirium, Immobility, and Sleep Disruption in Adult Patients in the ICU. Crit Care Med [Internet]. 2018 Sep;46(9):e825–73. Available from: http://journals.lww.com/00003246-201809000-00029
4. Chen W, Hu S, Liu X, Wang N, Zhao J, Liu P, et al. Intensive care nurses’ knowledge and practice of evidence-based recommendations for endotracheal suctioning: a multisite cross-sectional study in Changsha, China. BMC Nurs. 2021 Dec 4;20(1):186.
5. Maggiore SM, Iacobone E, Zito G, Conti G, Antonelli M, Roietti RP. Closed versus open suctioning techniques. MINERVA ANESTESIOL. 2002;68:360–4.
6. Shimoda T, Sekino M, Higashijima U, Matsumoto S, Sato S, Yano R, et al. Removal of a catheter mount and heat-and-moisture exchanger improves hypercapnia in patients with acute respiratory distress syndrome. Medicine (Baltimore). 2021 Sep 10;100(36):e27199.
7. Tablan OC, Anderson LJ, Besser R, Bridges C, Hajjeh R, CDC, et al. Guidelines for preventing health-care–associated pneumonia, 2003: recommendations of CDC and the Healthcare Infection Control Practices Advisory Committee. MMWR Recomm reports Morb Mortal Wkly report Recomm reports. 2004 Mar 26;53(RR-3):1–36.
8. Stone RH, Bricknell SS. Experience With a New Device for Clearing Mucus From the Endotracheal Tube. Respir Care. 2011 Apr 1;56(4):520–2.
[…] L’ASPIRAZIONE DELLA VIA AEREA ARTIFICIALE – UPGRADE 2022 | Triggerlab […]
"Mi piace""Mi piace"