A cura di Francesco Baiguera

La capnografia volumetrica non è soltanto un grafico su un monitor: è una finestra aperta sullo scambio gassoso del paziente, capace di raccontare in tempo reale ciò che accade nei polmoni e nel circolo. Ho introdotto l’argomento con il post Capnografia Volumetrica: Monitoraggio Avanzato della CO₂, ma il suo potenziale clinico merita di essere esplorato ancora, perché dietro quelle curve si nascondono informazioni preziose per guidare decisioni rapide e consapevoli.
Per sfruttare appieno questa tecnologia servono due ingredienti: strumenti affidabili e competenze solide. Sul primo aspetto non è possibile intervenire direttamente, ma sul secondo sì: cercherò di offrire conoscenze, esempi e chiavi di lettura che aiutano a interpretare i dati con occhio critico e a trasformarli in azioni cliniche mirate.
La letteratura riporta applicazioni della capnografia volumetrica in scenari molto diversi, dalla gestione della ventilazione meccanica alla valutazione dello spazio morto. In ambito ventilatorio, i principali contesti d’uso sono sintetizzati nella figura 1.
Di seguito analizzo brevemente 3 aspetti: utilizzo della capnografia volumetrica nelle fasi precoci dell’ARDS, nella gestione della PEEP e nelle patologie polmonari ostruttive.
ARDS
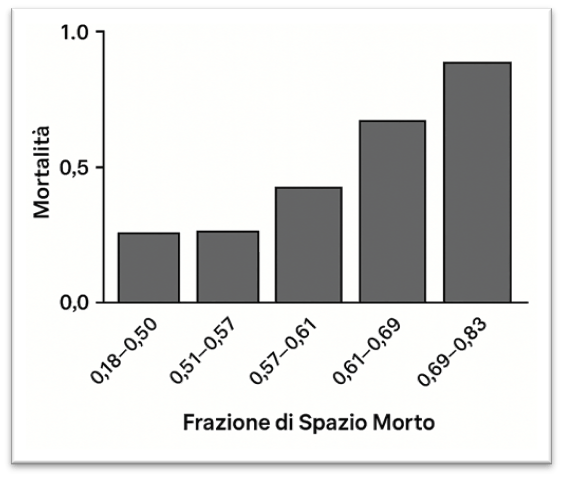
Introduco l’argomento partendo dal punto in cui ci siamo lasciati con il post del 20 giugno 2025: “tra tutte le variabili, lo spazio morto è quella maggiormente associata alla mortalità nei pazienti con ARDS”. Il rapporto tra spazio morto fisiologico e volume corrente (VD-PHYS/VT) è un parametro non invasivo di crescente importanza nella gestione dei pazienti con ARDS. Recenti evidenze hanno confermato il suo forte valore prognostico, dimostrando che valori significativamente più elevati di VD-PHYS/VT sono associati a esiti sfavorevoli e a una maggiore mortalità [1], [2].
Lo studio di Nuckton e collaboratori, in particolare, ha consolidato questo concetto, identificando l’aumento dello spazio morto come un predittore indipendente di mortalità nella fase precoce della malattia, ben visibile nella Figura 2 [2].
Un approccio sicuramente utile e altrettanto preciso nel quantificare lo spazio morto fisiologico nelle fasi precoci dell’ARDS è la capnografia volumetrica, che permette di misurare la pressione parziale di CO₂ espirata (PĒCO₂) e di separare il vero spazio morto fisiologico dalle alterazioni dovute allo shunt[1], [3], [4]. Questo monitoraggio fornisce parametri più specifici, come lo spazio morto alveolare (VDalv) e la pendenza della fase III (concetto affrontato nel post del 20 giugno 2025). Quest’ultima, in particolare, funge da indice del mismatch ventilazione/perfusione (V/Q): una sua riduzione indica una maggiore omogeneità V/Q e quindi un miglioramento della funzione polmonare[5]. Questo approccio offre ai clinici un parametro utile da monitorare nelle prime 24 ore o entro la prima settimana dall’insorgenza dell’ARDS.
In quest’ottica, l’affidabilità del rapporto PaO₂/FiO₂ vacilla. Infatti, se consideriamo ad esempio pazienti con ARDS soggetti a pronazione, la risposta benefica alla postura è legata ad una riduzione dello spazio morto, in aggiunta a riduzione dello shunt con conseguente riduzione della mortalità [6]. Per questo motivo, la variazione della PaCO₂ è oggi considerata un indicatore estremamente affidabile della risposta alla postura prona.[8]
GESTIONE PEEP E MANOVRE DI RECLUTAMENTO
Negli ultimi anni, la gestione personalizzata della PEEP è diventata uno degli argomenti più dibattuti in area critica. Sappiamo bene che impostare la PEEP “giusta” significa trovare un equilibrio delicato: da un lato mantenere gli alveoli aperti per migliorare l’ossigenazione e dall’altro evitare la sovradistensione. Tradizionalmente, la titolazione della PEEP si è basata su parametri come la compliance statica o l’andamento del rapporto PaO₂/FiO₂. Tuttavia, questi indicatori non sempre raccontano l’intera storia, soprattutto quando il problema non è solo ventilatorio ma anche perfusionale. È qui che la capnografia volumetrica entra in gioco come strumento prezioso.
Misurando il volume di CO₂ espirato (VeCO₂) atto per atto, la capnografia volumetrica offre una finestra diretta sul rapporto ventilazione/perfusione. In condizioni stabili di volume corrente e frequenza respiratoria, un aumento del VeCO₂ dopo una modifica della PEEP suggerisce un miglioramento del V/Q: più alveoli ventilati sono anche perfusi, e quindi più CO₂ viene eliminata. Al contrario, una riduzione del VeCO₂ può indicare che la nuova impostazione ha ridotto la perfusione (per esempio per sovradistensione) o ha peggiorato la ventilazione alveolare.
In pratica, il clinico può procedere per piccoli step: registrare il VeCO₂ basale, aumentare o ridurre la PEEP di 1–2 cmH₂O e osservare la risposta. Ripetendo il processo, si individua il punto in cui il VeCO₂ raggiunge il massimo senza segni di stress polmonare.
In definitiva, la capnografia volumetrica ci ricorda che la PEEP non è solo una questione di “quanto ossigeno entra”, ma anche di “quanto CO₂ esce”, e che ottimizzare entrambi i lati dello scambio gassoso è la chiave per una ventilazione davvero protettiva e mirata.
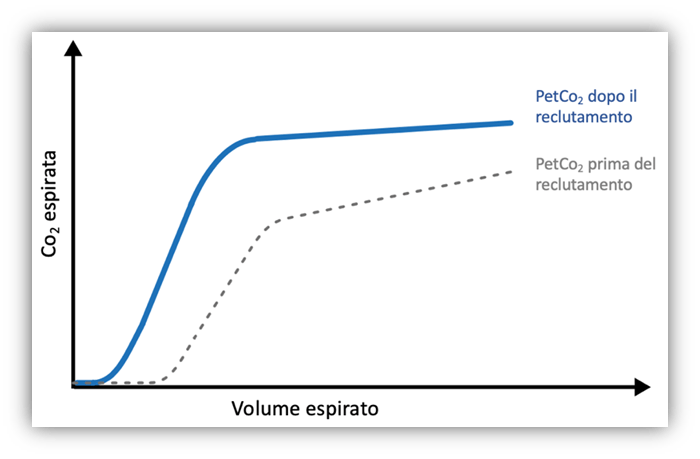
Rappresentazione grafica (Figura 3)
In un’ottica di reclutamento, la Fase I del tracciato può ridursi leggermente, indicando una diminuzione dello spazio morto anatomico. La pendenza della Fase II tende a diventare più accentuata, riflettendo un miglioramento della perfusione polmonare. Infine, la pendenza della Fase III mostra un miglioramento, attribuibile a una espirazione più omogenea del gas dai diversi compartimenti polmonari, segno di una ventilazione più uniforme.
MALATTIE POLMONARI OSTRUTTIVE
Queste patologie sono caratterizzate da uno svuotamento asincrono dei compartimenti polmonari, ciascuno con rapporti ventilazione/perfusione differenti, che alterano la dinamica espiratoria. Sappiamo già che la capnografia qualitativa (ovvero quella temporale che utilizziamo quotidianamente nelle nostre terapie intensive) evidenzia in modo ottimale qualsiasi forma di resistenza espiratoria. La morfologia “a pinna di squalo” è forse quella maggiormente rappresentativa di patologie ostruttive. Il capnogramma volumetrico aggiunge sicuramente informazione grafiche e numeriche adatte ad identificare in modo ottimale il fenomeno.
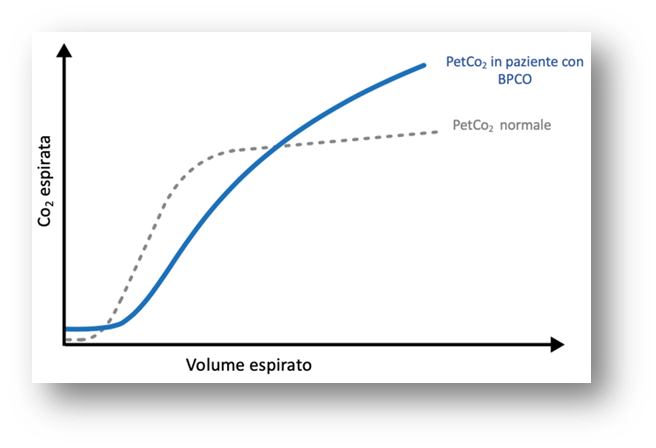
Rappresentazione grafica (Figura 4)
Nel paziente con BPCO, il capnogramma volumetrico mostra:
- Una Fase II prolungata, indicativa di un ritardo nell’espirazione del gas ricco di CO₂;
- Un aumento della PetCO₂, segno di una ridotta eliminazione di CO₂;
- Una pendenza della Fase III costantemente ascendente, senza raggiungimento di un plateau, che riflette una ventilazione non omogenea e una persistente espirazione da compartimenti con diversa compliance.
Nei pazienti con elevata resistenza delle vie aeree, il capnogramma volumetrico mostra (Figura 5):
- Una riduzione della pendenza della Fase II, dovuta al rallentato svuotamento iniziale degli alveoli;
- Una pendenza accentuata della Fase III, che riflette una distribuzione non uniforme della ventilazione e un aumento dello spazio morto alveolare.
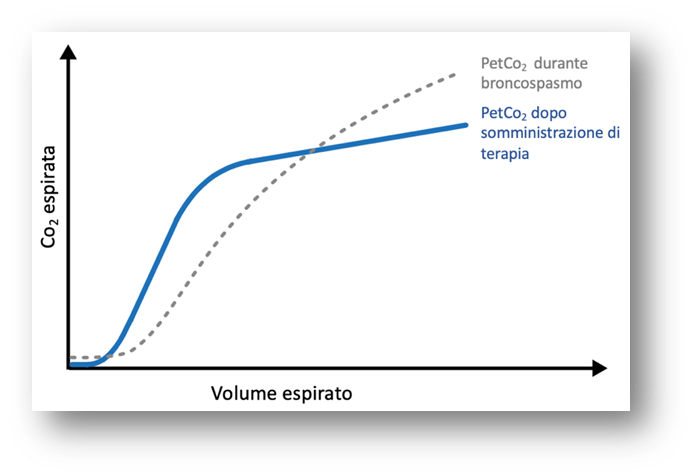
La qualità del monitoraggio può fornire informazioni preziose sull’efficacia della terapia inalatoria così come segue:
- Uno spostamento verso sinistra della Fase II è indicativo di una riduzione della resistenza delle vie aeree, segno di miglioramento clinico;
- Una diminuzione della pendenza della Fase III suggerisce una migliore distribuzione del gas e una riduzione dello spazio morto alveolare (VDalv).
Ciò che ho illustrato non si propone come sostituto dei metodi di monitoraggio tradizionali, ma come un complemento capace di arricchire la valutazione clinica. La capnografia volumetrica non è una tecnologia da contrapporre, bensì da integrare: uno strumento che, se inserito consapevolmente nel contesto gestionale, può offrire informazioni aggiuntive e raffinare il processo decisionale. Riconoscere il suo potenziale significa ampliare il nostro sguardo, adottando un approccio più sfaccettato e dinamico alla cura del paziente. Non si tratta di scegliere tra strumenti, ma di costruire un sistema di monitoraggio più completo, dove ogni tecnologia trova il proprio spazio e contribuisce in modo sinergico.
Un saluto e un abbraccio a tutti gli amici di Triggerlab
Francesco
BIBLIOGRAFIA
[1] R. H. Kallet, H. Zhuo, K. D. Liu, C. S. Calfee, and M. A. Matthay, “The Association Between Physiologic Dead-Space Fraction and Mortality in Subjects With ARDS Enrolled in a Prospective Multi-Center Clinical Trial,” Respir Care, vol. 59, no. 11, pp. 1611–1618, Nov. 2014, doi: 10.4187/respcare.02593.
[2] T. J. Nuckton et al., “Pulmonary Dead-Space Fraction as a Risk Factor for Death in the Acute Respiratory Distress Syndrome,” New England Journal of Medicine, vol. 346, no. 17, pp. 1281–1286, Apr. 2002, doi: 10.1056/NEJMoa012835.
[3] R. H. Kallet, J. A. Alonso, J.-F. Pittet, and M. A. Matthay, “Prognostic value of the pulmonary dead-space fraction during the first 6 days of acute respiratory distress syndrome.,” Respir Care, vol. 49, no. 9, pp. 1008–14, Sep. 2004.
[4] M. Cepkova et al., “Pulmonary Dead Space Fraction and Pulmonary Artery Systolic Pressure as Early Predictors of Clinical Outcome in Acute Lung Injury,” Chest, vol. 132, no. 3, pp. 836–842, Sep. 2007, doi: 10.1378/chest.07-0409.
[5] M. Mosing et al., “The effects of cardiac output and pulmonary arterial hypertension on volumetric capnography derived-variables during normoxia and hypoxia,” J Clin Monit Comput, vol. 29, no. 1, pp. 187–196, Feb. 2015, doi: 10.1007/s10877-014-9588-0.
[6] L. Gattinoni et al., “Decrease in Paco2 with prone position is predictive of improved outcome in acute respiratory distress syndrome*,” Crit Care Med, vol. 31, no. 12, pp. 2727–2733, Dec. 2003, doi: 10.1097/01.CCM.0000098032.34052.F9.
[7] P. Pelosi, L. Brazzi, and L. Gattinoni, “Prone position in acute respiratory distress syndrome,” European Respiratory Journal, vol. 20, no. 4, pp. 1017–1028, Oct. 2002, doi: 10.1183/09031936.02.00401702.
[8] Roy G Brower, Michael A Matthay, Alan Morris, David Schoenfeld, B Taylor Thompson, and Arthur Wheeler, “Ventilation with Lower Tidal Volumes as Compared with Traditional Tidal Volumes for Acute Lung Injury and the Acute Respiratory Distress Syndrome,” New England Journal of Medicine, vol. 342, no. 18, pp. 1301–1308, May 2000, doi: 10.1056/NEJM200005043421801.
Bibliografia supplementare consultata
- Roy G Brower et al., “Higher versus Lower Positive End-Expiratory Pressures in Patients with the Acute Respiratory Distress Syndrome,” New England Journal of Medicine, vol. 351, no. 4, pp. 327–336, Jul. 2004, doi: 10.1056/NEJMoa032193.
- M. O. Meade et al., “Ventilation Strategy Using Low Tidal Volumes, Recruitment Maneuvers, and High Positive End-Expiratory Pressure for Acute Lung Injury and Acute Respiratory Distress Syndrome,” JAMA, vol. 299, no. 6, p. 637, Feb. 2008, doi: 10.1001/jama.299.6.637.
- A. Mercat et al., “Positive End-Expiratory Pressure Setting in Adults With Acute Lung Injury and Acute Respiratory Distress Syndrome,” JAMA, vol. 299, no. 6, p. 646, Feb. 2008, doi: 10.1001/jama.299.6.646.
- L. Gattinoni et al., “Lung Recruitment in Patients with the Acute Respiratory Distress Syndrome,” New England Journal of Medicine, vol. 354, no. 17, pp. 1775–1786, Apr. 2006, doi: 10.1056/NEJMoa052052.
- P. M. Suter, H. B. Fairley, and M. D. Isenberg, “Optimum End-Expiratory Airway Pressure in Patients with Acute Pulmonary Failure,” New England Journal of Medicine, vol. 292, no. 6, pp. 284–289, Feb. 1975, doi: 10.1056/NEJM197502062920604.
- P. Terragni, G. Bussone, and L. Mascia, “Dynamic airway pressure-time curve profile (Stress Index): a systematic review.,” Minerva Anestesiol, vol. 82, no. 1, pp. 58–68, Jan. 2016.
- J. S. Hata et al., “The Effect of the Pressure–Volume Curve for Positive End-Expiratory Pressure Titration on Clinical Outcomes in Acute Respiratory Distress Syndrome,” J Intensive Care Med, vol. 29, no. 6, pp. 348–356, Nov. 2014, doi: 10.1177/0885066613488747.
- S. K. Sahetya and R. G. Brower, “The promises and problems of transpulmonary pressure measurements in acute respiratory distress syndrome,” Curr Opin Crit Care, vol. 22, no. 1, pp. 7–13, Feb. 2016, doi: 10.1097/MCC.0000000000000268.