Introduzione

Quando connettiamo un paziente al ventilatore, non stiamo intervenendo solo sull’apparato respiratorio. Stiamo modificando la fisiologia cardiovascolare in modo profondo e immediato. La ventilazione meccanica a pressione positiva (PPV) inverte la logica della respirazione spontanea, con conseguenze emodinamiche. Questo post percorre la fisiopatologia dell’interazione cuore-polmone: dalla pressione intratoracica alla curva di Guyton, dalla legge di Frank-Starling alla pressione transmurale, fino al monitoraggio e allo svezzamento come stress test cardiovascolare.
Continua a leggere: Interazione cuore-polmone durante ventilazione meccanica1. Pressione intratoracica: il concetto fondamentale
Durante la respirazione spontanea, l’inspirazione genera una pressione intratoracica negativa (Ppl ≈ −5/−8 cmH₂O). Questo gradiente riduce la pressione atriale destra, aumenta il ritorno venoso e favorisce il riempimento del ventricolo destro (VD).
Con la PPV accade l’opposto: ogni insufflazione aumenta la pressione intratoracica positivamente (a seconda del volume corrente, della compliance polmonare e della PEEP applicata). Questa pressione si trasmette a tutte le strutture intratoraciche, incluso il cuore e modifica in modo significativo i gradienti di pressione che regolano il riempimento e lo svuotamento di entrambi i ventricoli1.
2. Curva di ritorno venoso di Guyton
Guyton dimostrò che la gittata cardiaca non è determinata solo dalla pompa cardiaca, ma dal gradiente di pressione che spinge il sangue verso il cuore dalla periferia. Il ritorno venoso (RV) è espresso da:
- Pms (pressione media sistemica di riempimento): pressione che avrebbe il sistema vascolare se il cuore si fermasse. Dipende dalla volemia e dal tono venoso. Valore normale ≈ 7–8 mmHg
- PAD (pressione atriale destra ≈ PVC): la “contropressione” che il cuore oppone al ritorno venoso
- R_RV: resistenza al ritorno venoso, prevalentemente venosa
Il sangue torna al cuore perché la Pms è sempre maggiore della PAD. Più grande è questo gradiente, maggiore è il ritorno venoso2.
Come la PPV modifica la curva di Guyton
La PPV agisce direttamente sulla PAD: l’aumento della pressione intratoracica si trasmette all’atrio destro → la PAD aumenta → il gradiente (Pms − PAD) si riduce → il ritorno venoso cala. La Pms, in assenza di variazioni volemiche o di tono venoso, rimane invariata2.
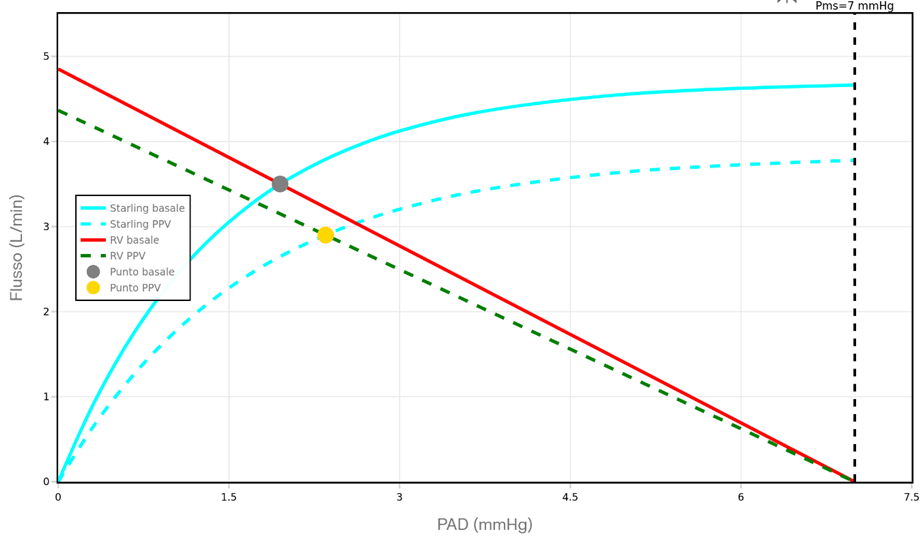
Adattato da: Guyton AC, 1955; Michard F & Teboul JL, Chest 2002.
Applicazioni pratiche della curva di Guyton
| Manovra | Effetto su Pms | Effetto su PAD | Risultato su Ritorno Venoso |
| Espansione volemica | ↑ | lieve ↑ | ↑ (se Ventricolo destro precarico dipendente) |
| Noradrenalina (venocostrizione) | ↑ | lieve ↑ | ↑ (utile nello shock) |
| PPV / ↑ PEEP | invariata | ↑↑ | ↓ |
| Passive Leg Raise | ↑ transitoria | lieve ↑ | ↑ transitorio |
| Ipovolemia | ↓ | ↓ | ↓ |
Limiti del modello di Guyton
Il modello di Guyton è uno strumento concettuale, ma presenta limiti fisiologici e clinici rilevanti3:
- Semplificazione eccessiva del sistema vascolare. Il modello originale assume un unico compartimento arterioso e uno venoso con resistenza totale fissa. Non descrive adeguatamente situazioni di esercizio fisico, shock distributivo, scompenso cardiaco cronico, variazioni posturali o stati iperdinamici — contesti comuni in terapia intensiva4.
- La Pms non è direttamente misurabile in un cuore battente. La pressione media sistemica di riempimento (Pms) è definita teoricamente in assenza di flusso. In un paziente emodinamicamente instabile con cuore battente, la sua stima richiede metodi complessi che non sono sempre fattibili per instabilità emodinamica e richiedono sedazione profonda e paralisi neuromuscolare4.
- La relazione causale PAD → ritorno venoso è contestata. Brengelmann e altri autori hanno dimostrato che la curva di Guyton descrive una relazione funzionale, non necessariamente causale: non è la riduzione della PAD a “guidare” il ritorno venoso, ma è l’aumento della gittata cardiaca che abbassa la PAD. In un sistema fisiologico integrato, causa ed effetto sono bidirezionali3.
- Rischio di errori interpretativi clinici. Durante PPV con PEEP elevato, la PVC intracavitaria sale — non perché il VD sia pieno, ma perché la pressione intratoracica positiva viene trasmessa all’atrio destro. Un’applicazione acritica del modello di Guyton può portare a non somministrare fluidi in un paziente che in realtà ne ha bisogno, ragionando in modo errato: “PVC alta = VD pieno = non serve volume.”
In realtà la pressione che conta è quella transmurale (Ptm,VD = PVC − Ppl): con PEEP 10 cmH₂O, circa 5 mmHg di quella PVC sono “artificiali” e dovuti alla pressione pleurica aumentata, non a un VD effettivamente riempito. Il paziente può essere ipovolemico relativo nonostante una PVC apparentemente elevata4.
In sintesi: il modello di Guyton è utile per ragionare sul ritorno venoso in clinica e non come assunto fisiologico assoluto.
3. Legge di Frank-Starling e dipendenza dal precarico
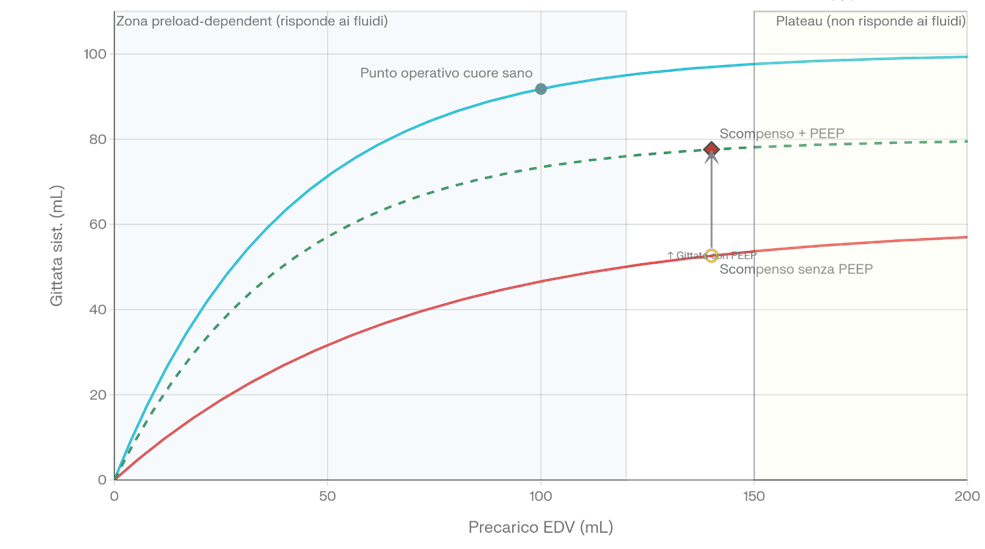
La legge di Frank-Starling descrive la relazione tra precarico ventricolare e gittata sistolica: maggiore è il riempimento ventricolare in diastole (EDV), maggiore è la forza di contrazione e la gittata. L’allungamento dei sarcomeri in diastole aumenta il numero di ponti actina-miosina attivabili, ottimizzando la forza contrattile5.
La curva ha una porzione ascendente — dove ogni aumento di precarico genera un proporzionale aumento di gittata — e una porzione piatta, in cui il cuore è saturo di volume e ulteriori apporti non producono beneficio (Figura 2).
Come la PPV sposta l’interazione precarico-gittata sulla curva di Starling
La PPV agisce sul precarico in modo ciclico e dinamico ad ogni atto respiratorio:
Inspirazione meccanica:
↑ Pressione intratoracica → ↓ gradiente di ritorno venoso → ↓ riempimento VD → VD scende sulla curva di Starling → ↓ gittata sistolica VD. Dopo 2–3 battiti (tempo di transito polmonare) → ↓ precarico VS → ↓ gittata sistolica VS in fase espiratoria.
Espirazione meccanica:
↓ Pressione intratoracica → ↑ ritorno venoso → ↑ riempimento VD → VD risale sulla curva di Starling → dopo il transito polmonare → ↑ gittata VS nella fase post-espiratoria.
Queste oscillazioni cicliche generano le variazioni periodiche della pressione differenziale (Pulse Pressure Variation, PPV) e del volume sistolico (Stroke Volume Variation, SVV) osservabili sul monitoraggio emodinamico.
Dipendenza dal Precarico: il significato clinico
Un paziente è fluid-responder solo se entrambi i ventricoli si trovano nella porzione ascendente della curva di Starling (dipendenza dal precarico). Secondo Michard e Teboul6, le variazioni cicliche della gittata sistolica indotte dalla PPV sono proporzionali alla dipendenza dal precarico biventricolare:
- SVV > 13% o PPV > 12–13% → entrambi i ventricoli nel tratto ascendente → il paziente risponderà positivamente all’espansione volemica
- SVV e PPV bassi → ventricoli sulla porzione piatta → aggiungere volume non migliorerà la gittata e aumenterà la congestione
Principali limiti comuni di SVV e PPV7,8
- Richiedono ventilazione meccanica controllata, senza atti spontanei: il respiro spontaneo altera in modo imprevedibile le variazioni respiro-correlate di pressione/stroke volume.
- Necessitano di volume corrente “alto” (≈≥ 8 ml/kg di PBW): con basso volume corrente le variazioni indotte dal respiro sono troppo piccole per discriminare i responsivi ai liquidi.
- Ritmo sinusale obbligato: aritmie (soprattutto FA) introducono variazioni battito-battito che “sporcano” il segnale respiro-correlato, rendendo inaffidabile il calcolo di PPV/SVV.
- Necessaria buona qualità del segnale pressorio: artefatti, sovra/sotto-smorzamento della curva, cateteri periferici molto distali possono falsare la pulse pressure e lo stroke volume derivato.
- Cut-off non universali: il famoso 10–13% (PPV/SVV) non è valido per tutti; gli studi mostrano soglie tra ≈8,5 e 15,5% e un’ampia “zona grigia” in cui non è possibile decidere con sicurezza se somministrare o meno fluidi.
- Dipendenza da PEEP, compliance toraco‑polmonare e pressione intratoracica: PEEP alta, polmone rigido o pressione addominale elevata amplificano le variazioni e possono far sovrastimare la “fluid responsiveness”.
- Come sempre nella clinica un solo dato non è dirimente, ma è necessario integrarlo con altri, ad esempio derivanti dal monitoraggio avanzato (catetere di Swan-Ganz o PiCCO). I miei maestri mi dicono che spesso il difficile è porsi la domanda giusta!
4. Pressione transmurale e ventilazione meccanica: VD e VS
La pressione intracavitaria che leggiamo sui monitor (PVC, PAD) non riflette il precarico reale. Il parametro fisiopatologicamente corretto è la pressione transmurale: la differenza tra la pressione all’interno della cavità e quella esterna alla parete, approssimata alla pressione pleurica (Ppl)1.
Pressione transmurale del Ventricolo destro, VD (precarico reale)
Durante PPV, Ppl aumenta; la PVC intracavitaria sale, ma di meno. La pressione transmurale del VD scende, indicando un VD meno riempito di quanto sembri. Con PEEP = 10 cmH₂O e normale compliance toracica, circa il 50% della pressione delle vie aeree si trasmette alla pleura1: una PVC di 10 mmHg in queste condizioni corrisponde a una pressione transmurale reale di circa 5 mmHg.
Pressione transmurale del Ventricolo sx, VS (postcarico reale)
Il VS pompa verso l’aorta extra toracica. Il suo postcarico effettivo è la pressione transmurale sistolica:
Durante PPV, Ppl ↑ → la pressione transmurale sistolica del VS scende → il VS deve lavorare meno per vincere il postcarico. Questo è il meccanismo con cui CPAP e NIV con PEEP migliorano la funzione sistolica del VS nell’edema polmonare acuto cardiogeno: non agiscono direttamente sugli scambi gassosi in prima istanza, ma scaricano il VS, che migliora la propria gittata e riduce la congestione polmonare9.
Asimmetria VD–VS: come lavorano durante ventilazione meccanica
| Ventricolo destro (VD) | Ventricolo sinistro (VS) | |
| Postcarico contro cui lavora | PVR — vasi polmonari intratoracici | Resistenze sistemiche — aorta extra toracica |
| Effetto PPV sul postcarico | ↑ (se sovradistensione → ↑ PVR) | ↓ (↓ Ptm sistolica) |
| Effetto PPV sul precarico | ↓ (↓ ritorno venoso) | ↓ (ridotto output VD) |
| Risposta in cuore sano | ↓ gittata | ↓ gittata |
| Risposta in scompenso VS | Neutro / negativo | ↑ gittata (↓ postcarico prevale) |
5. Effetti sul ventricolo destro
Il VD è la struttura più vulnerabile alla PPV: parete sottile, alta compliance, funzione da generatore di flusso a bassa pressione. La PPV lo aggredisce su due fronti simultanei1.
Riduzione del precarico
Come descritto dalla curva di Guyton, l’aumento della PAD durante PPV riduce il gradiente (Pms − PAD) → ↓ ritorno venoso → ↓ riempimento VD. La PEEP amplifica questo effetto in modo “dose-dipendente”1.
- PEEP 0 cmH₂O → ↓ gittata cardiaca circa del 10% rispetto alla respirazione spontanea
- PEEP 9 cmH₂O → ↓ gittata cardiaca circa del 18%
- PEEP 16 cmH₂O → ↓ gittata cardiaca circa del 36%
Aumento del postcarico (↑ resistenze vascolari polmonari, PVR)
Il rapporto tra volume polmonare e resistenze vascolari polmonari (PVR) segue una curva a U: il valore minimo di PVR si ottiene alla capacità funzionale residua (FRC). Sia il collasso alveolare sia la sovradistensione aumentano le PVR2. Con volumi correnti elevati o PEEP eccessiva, le PVR aumentano, oppongono resistenza all’eiezione del VD e può portare al cuore polmonare acuto (ACP)10.
6. Interdipendenza ventricolare
VD e VS condividono il setto interventricolare e sono racchiusi in un pericardio di volume relativamente fisso. Quando il VD si dilata — per aumento del postcarico o sovraccarico di volume, occupa spazio all’interno del pericardio e sposta il setto verso sinistra in diastole, riducendo il volume telediastolico del VS e la sua gittata: è il cosiddetto effetto Bernheim inverso, o interdipendenza diastolica2. Il meccanismo si amplifica durante la PPV perché la pressione pericardica stessa aumenta con la pressione intratoracica, riducendo contemporaneamente la pressione transmurale di entrambi i ventricoli1. Clinicamente si manifesta come:
- Movimento paradosso del setto all’ecocardiografia;
- Ipotensione refrattaria ai fluidi: il VS è compresso dal VD dilatato, non ipovolemico.
7. Effetti sul VS e CPAP nell’EPA cardiogeno
Cuore sano o ipovolemico: opera nella porzione ascendente della curva di Starling → è precarico-dipendente → la riduzione di precarico indotta dalla PPV sposta verso il basso lungo la curva → ↓ gittata sistolica.
Cuore scompensato con sovraccarico e alta pressione di riempimento: opera su una curva di Starling depressa (contrattilità ridotta, alta tensione di parete).
L’applicazione di una PEEP anche modesta (5–10 cmH₂O) nell’EPA cardiogeno genera un circolo virtuoso5:
- ↓ Postcarico transmurale VS → ↑ gittata sistolica VS
- ↓ Ritorno venoso → ↓ precarico VS → ↓ pressione di riempimento → ↓ congestione polmonare
- ↑ Ossigenazione → ↓ vasocostrizione ipossica polmonare → ↓ postcarico VD
Il risultato è una riduzione della congestione polmonare, miglioramento degli scambi gassosi e scarico del lavoro cardiaco, spesso senza necessità di intubazione.
8. PEEP: effetti contesto-dipendenti
La PEEP è il setting ventilatorio con il maggiore impatto emodinamico. I suoi effetti dipendono interamente dal contesto clinico e non sono prevedibili a priori2.
| Situazione clinica | Effetto della PEEP |
| Polmone collassato (reclutamento) | ↓ PVR, ↓ vasocostrizione ipossica → benefico |
| Sovradistensione | ↑ PVR, ↑ postcarico VD → dannoso |
| Scompenso VS con edema polmonare | ↓ postcarico transmurale VS → benefico |
| Ipovolemia | ↓ precarico → ↓ gittata → pericoloso |
| BPCO / iperinflazione dinamica | Auto-PEEP → ↑ PVR + ↓ ritorno venoso → dannoso |
La PEEP “ottimale” è quella che massimizza il mantenimento del reclutamento alveolare minimizzando la sovradistensione e le sue conseguenze emodinamiche2.
9. Iperinflazione dinamica: emergenza emodinamica
Nei pazienti con ostruzione al flusso espiratorio (asma acuta grave, BPCO riacutizzata), il tempo espiratorio può essere insufficiente a svuotare completamente gli alveoli prima dell’atto successivo, con accumulo progressivo di aria generando PEEP intrinseca11.
Le conseguenze emodinamiche sono cumulative:
- ↑ progressiva pressione intratoracica → ↓ gradiente di ritorno venoso (Guyton)
- ↑ PVR → ↑ postcarico VD
- Compressione delle strutture cardiache e riduzione della compliance ventricolare
- In casi estremi: collasso cardiovascolare
Come riconoscerla
- Ipotensione ingravescente dopo inizio della ventilazione, non responsiva ai fluidi
- Forma d’onda del flusso espiratorio che non torna a zero prima dell’atto successivo sul ventilatore
- PEEP intrinseca misurabile con manovra di pausa espiratoria
Le misure comuni di intervento sono ridurre la frequenza respiratoria, aumentare il tempo espiratorio, ridurre il volume corrente11.
10. Svezzamento come stress test cardiovascolare
La liberazione dalla ventilazione meccanica è un momento fisiopatologicamente critico sul piano emodinamico. La ripresa della respirazione spontanea durante il trial di svezzamento (SBT) rappresenta un test da sforzo cardiovascolare acuto per tre meccanismi simultanei1.
1. Reintroduzione della pressione intratoracica negativa
Il diaframma genera Ppl negative fino a −10/−15 cmH₂O → brusco aumento del ritorno venoso → ↑ precarico biventricolare.
2. Aumento del postcarico transmurale del VS
Con Ppl negativa, la pressione transmurale sistolica del VS aumenta → il VS deve fare più lavoro per vincere il postcarico → ↑ consumo miocardico di O₂.
3. Aumento del lavoro respiratorio
Il lavoro muscolare respiratorio aumenta il consumo di O₂ sistemico e riduce la riserva cardiovascolare.
Edema polmonare da svezzamento (weaning-induced pulmonary edema, WIPO)
Nei pazienti con disfunzione diastolica, sistolica o coronaropatia non riconosciuta, la combinazione di questi meccanismi può portare a un rapido aumento della pressione di riempimento del VS → congestione polmonare acuta → ipossiemia → fallimento dell’estubazione. La disfunzione sistolica del VS e i parametri ecocardiografici di disfunzione diastolica durante SBT sono predittori indipendenti di fallimento dello svezzamento12.
Come identificarlo12
- Comparsa o peggioramento di B-lines all’ecopolmonare durante SBT
- Aumento della pressione arteriosa differenziale e della frequenza cardiaca durante SBT
- NT-proBNP elevato pre-svezzamento come predittore di rischio
- Miglioramento rapido con ripresa della PPV
Conclusioni
- La ventilazione meccanica modifica simultaneamente precarico e postcarico di entrambi i ventricoli.
- La PVC non è il precarico reale. Con PEEP elevata, fino al 50% della PVC è “artificiale”. La pressione che conta è quella transmurale.
- Il ventricolo destro è la struttura più vulnerabile durante ventilazione meccanica.
- CPAP/NIV nell’edema polmonare acuto: il meccanismo è anche emodinamico, non solo respiratorio.
- Lo svezzamento è un test da sforzo. La ripresa del respiro spontaneo è il momento emodinamicamente più critico.
Un caro saluto a tutti, Cristian
Bibliografia
- Corp A, Thomas C, Adlam M. The cardiovascular effects of positive pressure ventilation. BJA Education. 2021;21(6):202–9. doi:10.1016/j.bjae.2021.01.002
- Zakynthinos GE, Tsolaki V, Mantzarlis K, et al. Navigating heart-lung interactions in mechanical ventilation: pathophysiology, diagnosis, and advanced management strategies in acute respiratory distress syndrome and beyond. J Clin Med. 2024;13(24):7788. doi:10.3390/jcm13247788
- Brengelmann GL. A critical analysis of the view that right atrial pressure determines venous return. J Appl Physiol. 2003;94(3):849–59. doi:10.1152/japplphysiol.00868.2002
- Magder S. Bench-to-bedside review: An approach to hemodynamic monitoring — Guyton at the bedside. Crit Care. 2012;16(5):236. doi:10.1186/cc11395
- Mahmood S, Pinsky MR. Heart-lung interactions during mechanical ventilation: the basics. Ann Transl Med. 2018;6(18):349. doi:10.21037/atm.2018.04.29
- Michard F, Teboul JL. Using heart-lung interactions to assess fluid responsiveness during mechanical ventilation. Crit Care. 2000;4(5):282–9. doi:10.1186/cc710
- Monnet X, Teboul JL. Prediction of fluid responsiveness: an update. Ann Intensive Care. 2016;6(1):111. doi:10.1186/s13613-016-0216-7
- Myatra SN, Prabu NR, Divatia JV, et al. The changes in pulse pressure variation or stroke volume variation after a “tidal volume challenge” reliably predict fluid responsiveness during low tidal volume ventilation. Crit Care Med. 2017;45(3):415–21. doi:10.1097/CCM.0000000000002183
- Yuriditsky E, et al. How I teach: heart-lung interactions during mechanical ventilation. ATS Scholar. 2024. doi:10.34197/ats-scholar.2024-0059HT
- Boissier F, Katsahian S, Razazi K, et al. Prevalence and prognosis of cor pulmonale during protective ventilation for acute respiratory distress syndrome. Intensive Care Med. 2013;39(10):1725–33. doi:10.1007/s00134-013-2941-9
- Pinsky MR. Heart-lung interactions during mechanical ventilation. Ann Am Thorac Soc. 2018;15(Suppl 1):S45–S48. doi:10.1513/AnnalsATS.201704-339FR
- Dres M, Teboul JL, Monnet X. Weaning the cardiac patient from mechanical ventilation. Curr Opin Crit Care. 2014;20(5):493–8. doi:10.1097/MCC.0000000000000131